- 1 Спектр атома водорода
- 2 Корпускулярно-волновой дуализм квантовой частицы
- 3 Волновое уравнение Шрёдингера
- 4 Простейшие движения микрочастицы
- 5 Моменты. Векторная модель атома
- 6 Многоэлектронный атом
- 7 Кристаллы
- 8 Сверхпроводимость
- 9 Атомное ядро
- 10 Модели атомного ядра
- 11 Радиоактивность
- 12 Альфа-распад
- 13 Бета-распад
- 14 Электронный захват
- 15 Гамма-излучение
- 16 Эффект Мёссбауэра
- 17 Ядерные реакции
- 18 Деление и слияние ядер
- 19 Элементарные частицы
- 20 Кварковая модель адронов
- 21 Ускорители заряженных частиц
Физика атома и ядра (курс лекций)
1 Спектр атома водорода
Понятие спектра, его квалификация.
Спектр - это электромагнитное излучение, разделенное каким-либо способом так, что по каждому направлению распространяется монохроматическая волна, имеющая определенную частоту и длину.
Частота характеризует скорость повторяемости колебательного движения. Частоту измеряют количеством полных колебаний за единицу времени
\( v=\frac{1}{T} \), |
(1) |
где T - время, в течение которого тело совершает одно полное колебание, называется периодом колебания.
Распространение колебаний в среде называют волновым процессом. Оно характеризуется величиной, которую называют длиной волны. Понятие длины волны характеризует перемещение волновой поверхности за один период в зависимости от рода среды и частоты колебаний. Длиной волны называется расстояние между ближайшими точками на одном направлении, которые колеблется в одинаковой фазе и определяется формулой
λ=νT. |
(2) |
Изображение спектра электромагнитного излучения, проходящего через щель, на плоскости (экране, фотопластинке) также называется спектром. В зависимости от изображения на плоскости спектры бывают линейчатые, полосатые и сплошные. Линейчатые спектры состоят из узких линий различных цветов, разделенных темными промежутками (в цветном изображении). Полосатые спектры состоят из ряда светлых полос, разделенных темными промежутками. Примером сплошного спектра является спектр белого света, в котором каждый цвет плавно переходит в другой без темных промежутков.
Спектр подразделяется на три области: инфракрасную, видимую и ультрафиолетовую. Они относятся различным диапазонам частот (или длин волн).
Спектры отличают способами их получения. Нагревая тела, их можно заставить испускать лучи, относящихся к различным областям излучения в зависимости от температуры нагрева. Спектры, полученные нагревом тел, называются спектрами испускания. Они бывают сплошными, линейчатыми и полосатыми. Есть другой способ получения спектра. Пропускают пары газов твердого тела через прозрачные тела. При этом прозрачное тело поглощает часть проходящего через него излучения, спектр, полученный таким способом, называется спектром поглощения. Спектры поглощения могут быть линейчатыми или полосатыми.
Спектры различают по роду их источников. Поэтому спектры бывают атомными, молекулярными, а также бывают спектры газов твердых тел. Атомные спектры являются дискретными спектрами, молекулярные спектры полосатыми, а спектры нагретых твердых тел сплошными.
Приборы для получения и исследования спектров называются спектральными приборами. Для визуального наблюдения спектром используются спектроскопами, для фотографирования - спектрографами. Основным элементом таких устройств является диспергирующая среда в виде трехгранных призм или дифракционных решеток.
Спектр атома водорода.
В видимой области спектральные линии атомного водорода в своей последовательности обнаруживает простые закономерности. Она выражена эмпирической формулой Бальмера
\( \lambda= \lambda_ \infty\frac{n^2}{n^2-4} \), n=3,4,...,λ∞=3645,6 Å. |
(3) |
Из формулы (3) и экспериментальных наблюдений вытекает, что линии серии сгущаются по мере продвижению к концу серии, интенсивность линий серии уменьшаются также по мере продвижению к концу серии. Первая линия серии называется головной. Поскольку в конце серии происходит наложение линий друг на друга, нельзя определить последнюю линию серии. Ее определяют как границу серии - линию с номером, равной бесконечности. Дальнейшие исследования показали, что формулу Бальмера можно представить в более симметричном виде
\( \widetilde{v}={R}\left(\frac{1}{2^2}-\frac{1}{n^2}\right) \), \( R=\frac{4}{ \lambda_ \infty} \approx1,097 \cdot{10}^{-7} м^{-1} \). |
(4) |
Здесь введена новая переменная, так называемое спектроскопическое волновое число
\( \widetilde{v} \equiv\frac{1}{ \lambda} \). |
(5) |
Формула, введенная Бальмером для видимой области спектра, оказалась полезной для вычисления и в других областях спектра. Можно формулу (4) переписать следующим образом
\( \widetilde{v}=R\left(\frac{1}{m^2}-\frac{1}{n^2}\right) \), m=1,2,..., n=m+1,n+2,... |
(6) |
Обычно квантовое число m называют номером серии, а число n - номер линий в данной серии с номером m. Известны и исследования пять серий: m=1 (серия Лаймана), m=2 (серия Бальмера), m=3 (серия Пашена), m=4 (серия Пфунда), m=5 (серия Брэкета).
В еще более универсальном виде формула примет вид
\( \widetilde{v}=T(m)-T(n) \). |
(7) |
Здесь T(m) или T(n) называются спектральными термами. Это и есть основной закон излучения атома, называется комбинационным принципом Ридберга-Ритца.
Согласно Бору комбинационный принцип является своеобразным выражением квантовых законов, управляющих внутриатомными процессами. Он раскрыл физических смысл спектральных термов. Применение формулы (7) и гипотезы Планка ΔE=ћν к квантовому переходу дает соотношение между спектральным термом и соответствующим уровнем энергии
E(n)=-chT(n). |
(8) |
Итак, каждому спектральному терму соответствует определенное значение энергии атома.
Боровская теория водородоподобного атома.
Модель атома Бора формулируется системой трех уравнений
\( m\frac{{v}^2}{r}=k\frac{Ze^2}{r^2} \), \( E=\frac{m{v}^2}{2}-k\frac{Z{e}^2}{r} \), mνr=nћ |
(9,10,11) |
Уравнение (11) называется условием квантования электронных орбит, условием выбора избранных орбит, по которым может двигаться электрон внутри атома. Переменная n принимает положительные целые числа, имеет смысл номера избранной орбиты и носит название квантового числа. Решая систему, находим радиус орбиты электрона, его скорость и энергию на этой орбите.
(1)+(2)⇒\( v_n=k\frac{e^2}{\hbar} \cdot\frac{Z}{n} \), \( r=\frac{1}{k} \cdot\frac{{\hbar}^2}{me^2} \cdot\frac{n^2}{Z} \). |
|
(1)+(3)⇒\( E=-k\frac{Ze^2}{2r} \), \( E=-k^2\frac{m{e}^4}{2\hbar} \cdot\frac{Z^2}{n^2} \). |
Исходя из них, получим величины теории атома Бора из комбинаций универсальных постоянных
\( r_1=\frac{1}{k} \cdot\frac{{\hbar}^2}{m{e}^2}=0,529 \)Å, \( v_1=k\frac{e^2}{\hbar} \), \( \alpha=k\frac{e^2}{{\hbar}c} \approx\frac{1}{137} \). |
(12) |
Применяя полученные результаты к квантовому переходу, получим теоретическую формулу для расчета постоянной величины Ридберга
\( R'=k^2\frac{me^2}{2{\hbar}^3}=2,07 \cdot{10}^{16}c^{-1} \), или \( R=k^2\frac{{me}^4}{4 {\pi }c{\hbar}^3}=1,097 \cdot{10}^7м^{-1} \). |
(13) |
Учет движения ядра с массой M совместно с электроном с массой m вокруг собственной оси системы имеем
\( R=R_ \infty\frac{1}{1+m/M} \). |
(14) |
Модель излучающего электрона.
К атомам щелочных металлов относятся: литий(Li), натрий(Na), калий(K), рубидий(Rb), цезий(Cs), франций(Fr). Они имеют электрон, удаленный от ядра дальше всех электронов, слабосвязанный с ним.
Атом щелочных металлов имеет на один атом больше, чем у предыдущего атома инертного газа в таблице Менделеева. Этот электрон и слабо связан с ядром атома, и легко его оторвать от атома. Атомы инертных газов известны большой устойчивостью, а атомы щелочных металлов химически активны.
Другим замечательным моментов атом щелочных металлов является то, то в их спектрах наблюдаются серии, которые по внешнему виду в точности напоминают серии атома водорода.
Эти два обстоятельства - слабая связь внешнего электрона и «водородоподобность» спектров - позволяют построить следующий модель излучающего электрона: атом щелочного металла представляет собой систему, состоящую из атомного остова и одного внешнего электрона, который движется в электрическом поле остова. Атомный остов состоит из первых Z-1 внутренних электронов, и по своей структуре напоминает предыдущий атом инертного газа. Атомный остов есть наиболее устойчивая часть атома, слабо связанного внешним электроном. Внешний электрон отвечает за оптические и химические свойства атома в целом. Поэтому его называют излучающим или валентным.
Атомный остов более сложная структура, чем ядро атома водорода или любого другого водородоподобного иона с одним электроном. Поэтому электрическое поле такого остова нельзя считать полностью совпадающим с кулоновским полем точечного заряда. Следовательно, состояние внешнего электрона атомов щелочных металлов должно отличаться от состояний внешнего электрона внешнего электрона водородоподобных атомов. Имеется формула Ридберга, позволяющая приближенно вычислить термы атомов щелочных металлов:
\( T_{n,l} {\equiv}T(n,l)=\frac{R}{(n+ \delta(l))^2} \) |
(15) |
Из формулы (15) видно, состояния атомов щелочных металлов определяются двумя квантовыми числами. Главным квантовым числом n, определяющим в основном энергию атома, и побочным квантовым числом l, от которого зависит поправка σ(l) Ридберга, намного меньшей единицы.
Электронные состояния.
Энергия электрона в водородоподобных атомах характеризуется главным квантовым числом, а в случае атомов щелочных металлов - еще и побочным числом. Эти числами можно идентифицировать электронные состояния в атомах вообще. Главное квантовое число принимает значения
n=1,2,3,... |
(16) |
При фиксированном значении главного квантового числа побочное число принимает значения
l=1,2,3,...n |
(17) |
Вводится понятие основного состояния электрона. Это такое состояние, в котором электрон имеет наименьшую энергию. В случае атома водорода таким будет состояние, характеризуемое числом n=1. А основное состояние электрона в атоме щелочных металлов, естественно, будет характеризоваться числами n=1 и l=0. При значениях n>1, атомы находятся в возбужденных состояниях. Возбужденные состояния могут отличаться побочными числами, которые еще называются орбитальными. Таким образом, электронное состояние идентифицируется двумя переменными n,l, и состояние обозначается символом nl. Говорят, электрон находится в nl-состоянии или просто nl-электрон. При фиксированном значении главного квантового числа различают электронные состояния по орбитальному числу и вводят специальные обозначения для этих состояний. Приведем некоторые часто встречаемые в теории атома электронные состояния:
Квантовые числа электронного состояния |
Обозначения электронных состояний |
n=1, l=0 |
1s |
n=2, l=0,1 |
2s,2p |
n=3, l=0,1,2 |
3s,3p,3d |
n=4, l=0,1,2,3 |
4s,4p,4d,4f |
Квантовые переходы между электронными состояниями.
Электронные состояния и квантовые переходы между ними можно представить в виде диаграммы уровней и переходов. Определенные значения энергии электрона или атома изображаются горизонтальными линиями, расположенными в виде уровней. Отсюда другое название определенных значений энергии - уровни. Поскольку определенному состоянию электрона соответствует определенный уровень, то квантовые переходы можно изображать как переходы между уровнями (Рис.1). Каждой спектральной линии соответствует пара уровней: верхний уровень и нижний. Спектральные линии, принадлежащие к одной и той же серии, имеют общий нижний уровень. Существует правила отбора (или запрета). Согласно этим правилам возможны переходы, при которых орбитальные квантовые числа изменяются на единицу: Δl=1. Главные квантовые числа могут меняться на любое число. Серии спектров щелочных металлов имеют символические обозначения: \( \widetilde{v} \)=нижний уровень←верхний уровень. Для каждого металла свой символ нижнего уровня, отличающийся значением главного квантового числа. Для лития нижний уровень -2s, для натрия -3s и так далее. Укажем сериальные символы для лития:
\( \widetilde{v}=2s \leftarrow{n'p} \)(главная серия), \( \widetilde{v}=2p \leftarrow{n'd} \)(диффузная, первая побочная серия) |
|
\( \widetilde{v}=2p \leftarrow{n's} \)(резкая, вторая побочная серия), \( \widetilde{v}=2d \leftarrow{n'f} \)(основная серия). |
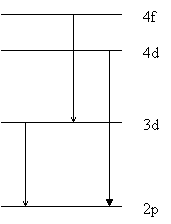
рис. 1
Кроме того, все серии щелочных металлов имеют легко доступную для наблюдения тонкую структуру, где каждая линия серии расщепляется на две или более компоненты. Для наблюдения простыми спектральными приборами, как правило, тонкая структура спектра щелочных металлов имеет дублетный характер.

